首页 >
行业动态 > 【COF手性改性识别】具有显著手性识别能力的胃蛋白酶功能化共价有机框架的构建与应用
【COF手性改性识别】具有显著手性识别能力的胃蛋白酶功能化共价有机框架的构建与应用
摘要:
中国药科大学李瑞军、季一兵老师等报道的本篇文章(Chem. Eur. J. 2024, 30, e202303827)中成功构建了一种基于共价有机框架(COF)的胃蛋白酶功能化材料(Pepsin@COF),该材料具有出色的手性识别能力,对映体过量(e.e.%)高达62.63%,并在手性分离方面展现出潜力。研究发现,固定化酶的活性与手性识别能力之间存在正相关关系,为设计用于手性分离的生物催化纳米系统提供了见解。
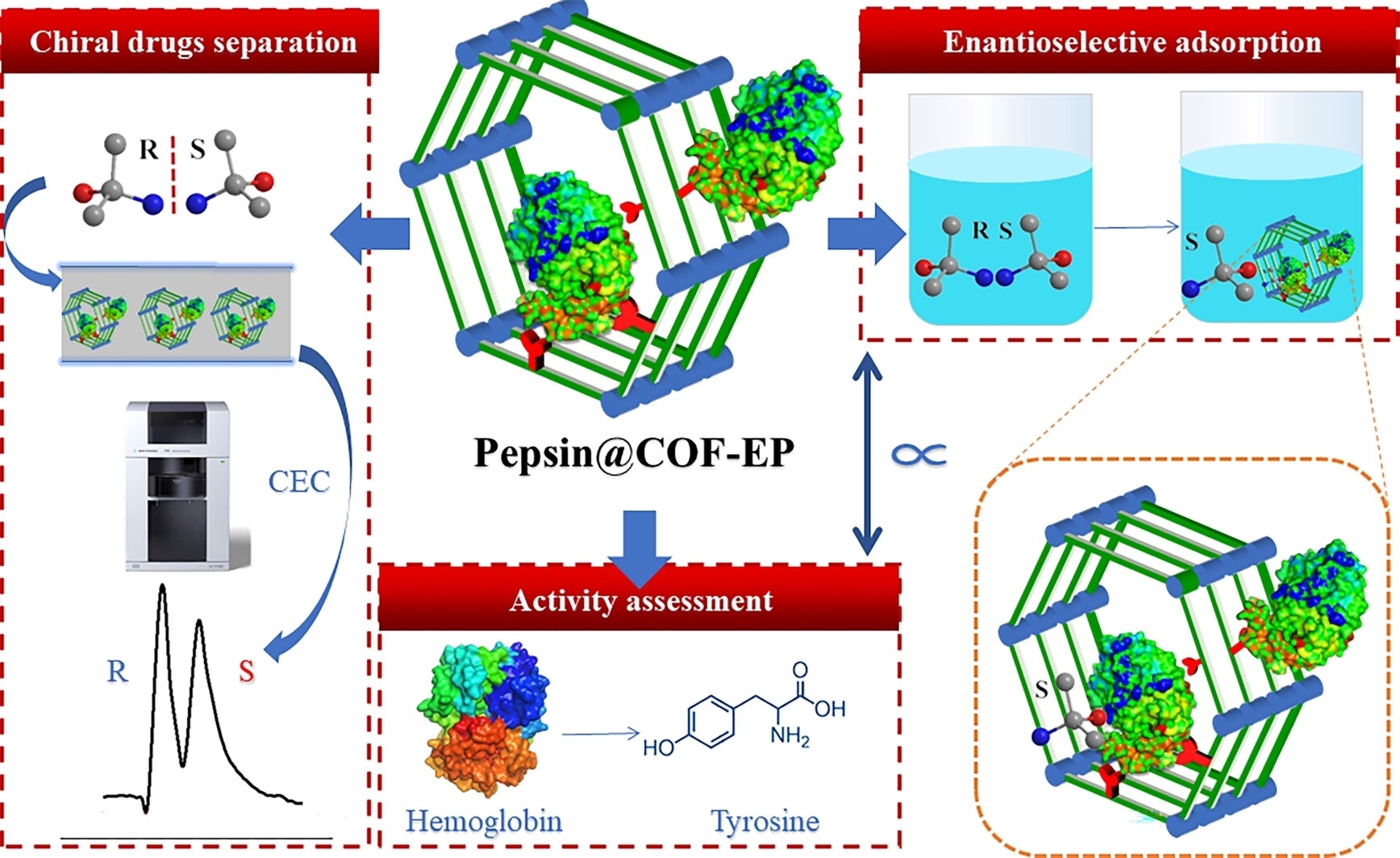
研究背景:
1) 酶在多个领域展现出巨大潜力,但由于稳定性低、提取分离纯化困难等问题,限制了其大规模应用。
2) 为了克服这些限制,研究者采用固定化策略来增强酶的稳定性并保持其活性。非均相基质的使用有助于从底物、产物和反应介质中分离固定化酶,实现其重复使用。
3) 本文作者选择了与胃蛋白酶尺寸相匹配的TAPB-DHTP-COF作为载体,通过引入环氧丙烷(EP)作为连接臂,实现了胃蛋白酶的有效固定化,并在手性分离分析领域进行了探索。
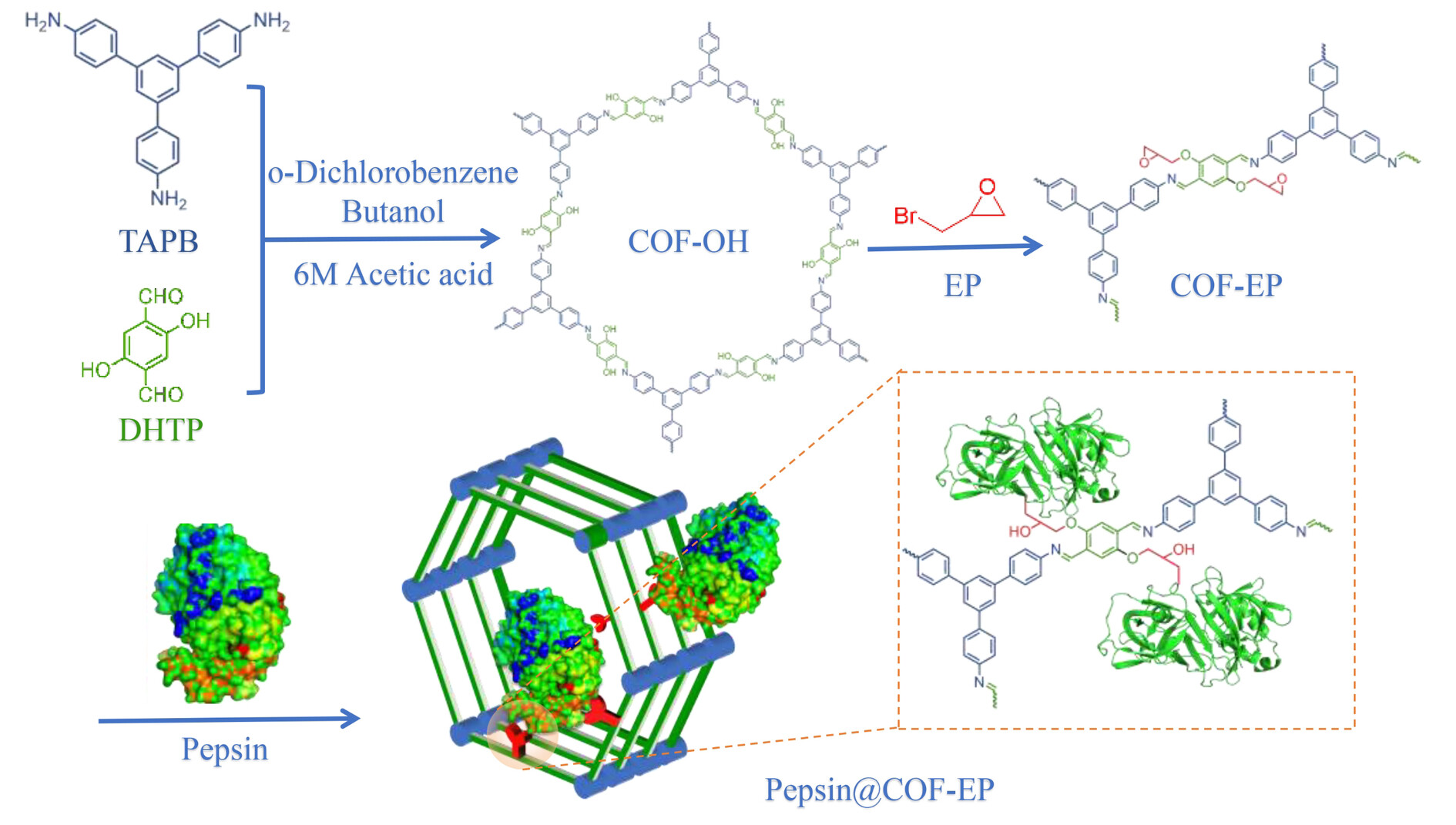
实验部分:
1. COF-OH的合成:
1) 通过溶剂热法合成了TAPB-DHTP-COF(记为COF-OH),具体操作包括将TAPB和DHTP单体按照一定比例溶解在溶剂中,经过一定时间的加热和冷却后,通过过滤、洗涤和干燥得到了COF-OH。
2) 合成的具体条件如温度、时间和溶剂配比在文献的支撑信息中有详细描述。
2. 胃蛋白酶的固定化:
1) 将合成的COF-OH与环氧丙烷(EP)反应,引入环氧基团,形成COF-EP。
2) 将COF-EP与胃蛋白酶溶液混合,在一定条件下反应,通过共价键将胃蛋白酶固定在COF-EP上,形成Pepsin@COF-EP。
3) 固定化的条件如pH值、温度和时间等在文献中有详细说明。
3. 手性识别能力的测试:
1) 进行了D,L-色氨酸的选择性吸附实验,以评估Pepsin@COF-EP的手性识别能力。
2) 实验中,将Pepsin@COF-EP与含有D,L-色氨酸的溶液接触,通过吸附前后色氨酸浓度的变化来评估手性识别能力。
4. 毛细管色谱柱的制备与手性药物分离:
1) 采用物理共混法将Pepsin@COF-EP作为固定相制备毛细管色谱柱。
2) 使用该色谱柱进行了多种手性药物的分离实验,如nefopam、propranolol、esmolol和clenbuterol。
分析测试:
1. FTIR光谱分析:
对COF-OH和Pepsin@COF-EP进行了FTIR光谱分析,结果显示了成功缩合和环氧基团的引入,以及胃蛋白酶的成功固定化。具体数据包括N-H伸缩振动的双峰消失,C=N伸缩振动的新峰出现,以及固定化后环氧基团振动峰的消失。
2. Zeta电位分析:
通过Zeta电位的变化证明了COF的成功修饰和胃蛋白酶的固定化,电位从5.01 mV变化到-11.4 mV。
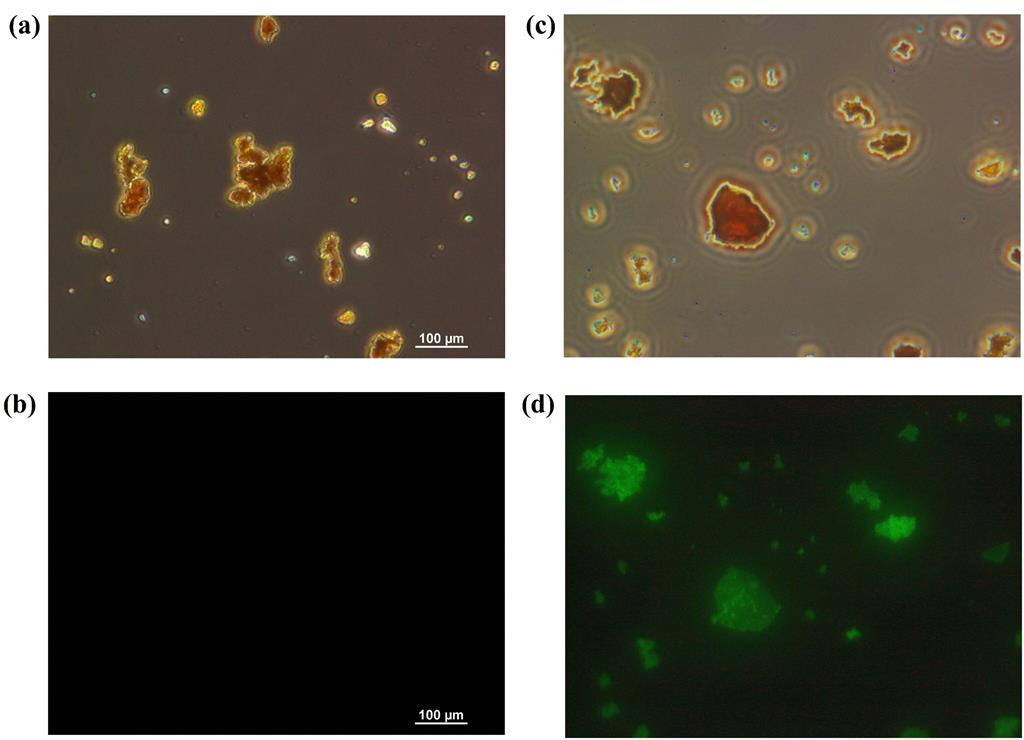
3. 荧光显微镜分析:
使用荧光显微镜观察了Pepsin@COF-EP的荧光,显示了均匀亮绿色的荧光,表明胃蛋白酶的成功固定化。
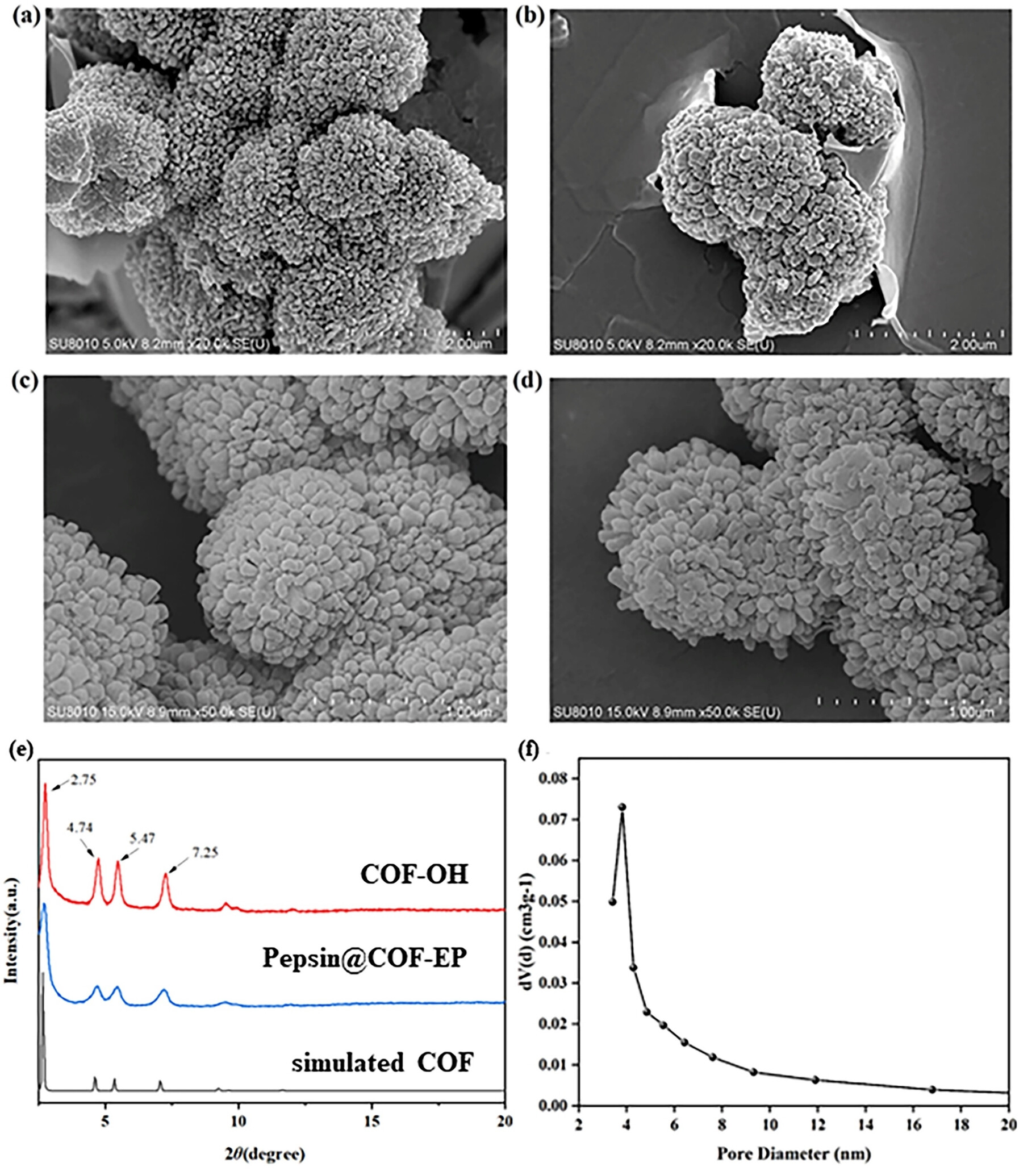
4. PXRD分析:
对COF-OH和Pepsin@COF-EP进行了PXRD分析,结果显示晶体结构未受EP和酶固定化过程影响。具体数据包括衍射峰位置的一致性。
5. SEM分析:
通过SEM观察了COF-OH和COF-EP的形貌,结果显示COF-EP保持了COF-OH的球形结构。具体数据包括形貌的直观展示。
6. 比表面积和孔隙度分析:
使用BET方法测定了COF-EP的比表面积为1239.40 m²/g,孔径为3.4 nm。这些数据表明胃蛋白酶可以在COF的表面和孔隙中固定化。
7. 温度和pH稳定性测试:
对固定化胃蛋白酶在不同温度和pH值下的稳定性进行了测试。在70°C下,固定化胃蛋白酶的相对活性为71.64%,而在pH 6.0时,固定化胃蛋白酶保持约50%的活性。
8. D,L-色氨酸吸附实验:
通过吸附实验评估了Pepsin@COF-EP的手性识别能力,结果显示共价固定化方法的对映体过量(e.e.%)值为60.10%,远高于物理吸附方法的37.17%。
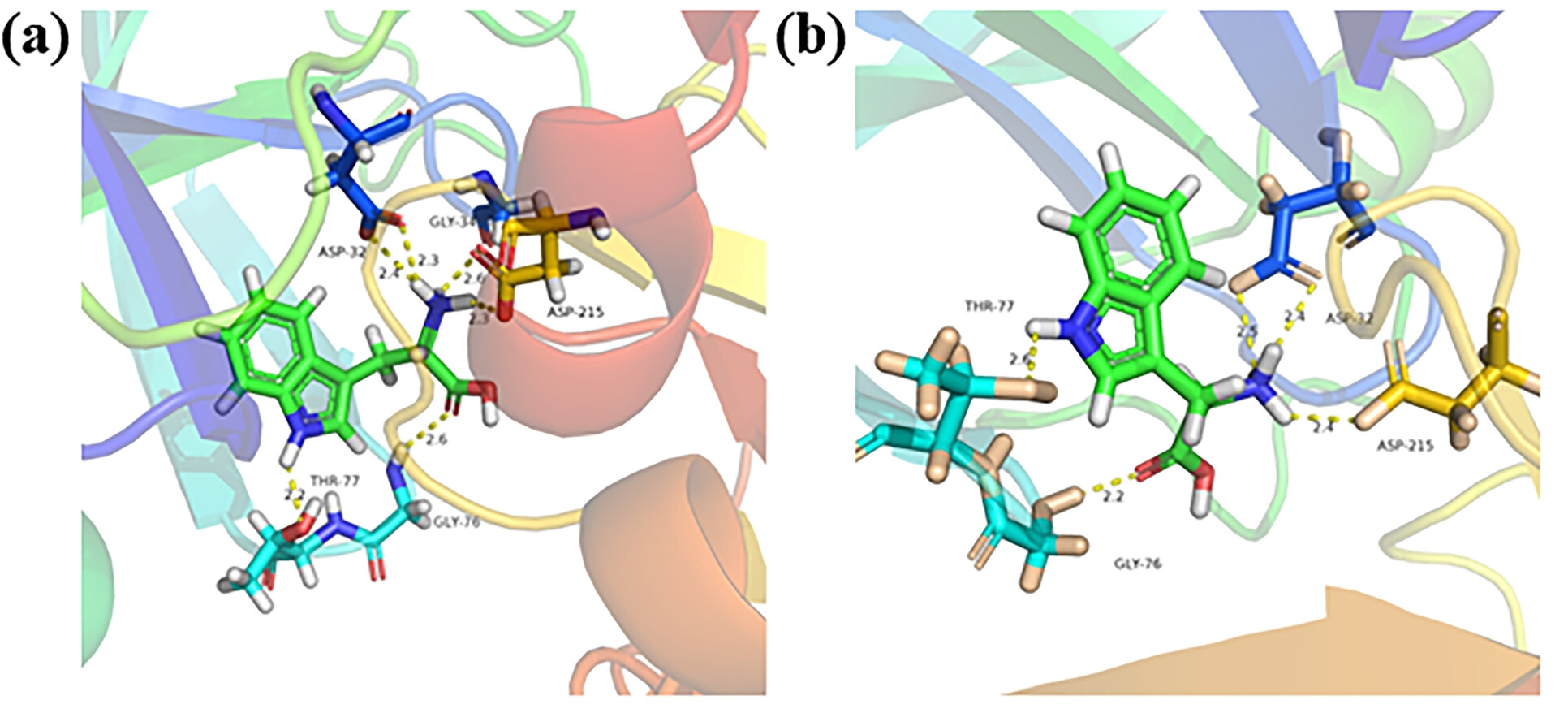
9. 分子对接分析:
使用AutoDock 4.2.6软件进行了胃蛋白酶与D,L-色氨酸的分子对接分析,结果显示胃蛋白酶与L-色氨酸的结合自由能(ΔG)为-5.4 kcal/mol,而与D-色氨酸的结合自由能为-3.7 kcal/mol,表明胃蛋白酶对L-色氨酸有更强的亲和力。
10. 毛细管色谱柱的制备与手性药物分离:
通过物理共混法制备了Pepsin@COF-EP毛细管色谱柱,并用于多种手性药物的分离。结果表明,nefopam实现了基线分离,而propranolol、esmolol和clenbuterol实现了部分分离。】
总结:
本研究通过将胃蛋白酶固定在孔径与其尺寸相匹配的COF上,实现了高效固定化(225 mg/g),并显著增强了手性识别能力。实验结果表明,固定化胃蛋白酶的活性与其手性识别能力正相关,为设计用于手性分离的生物催化纳米系统提供了新的思路。

展望:
尽管本研究取得了显著成果,但仍存在一些挑战,如COF在柱中的分散不足、酶的活性位点暴露有限以及质量传递速率限制。未来的研究可以集中在优化COF的分散性、提高酶的活性位点暴露以及改善质量传递速率,以进一步提升手性分离效率。此外,探索不同酶和多孔材料的组合,以及在其他手性分离领域的应用,也是未来研究的重要方向。
Construction and Application of a Pepsin-Functionalized Covalent Organic Framework with Prominent Chiral Recognition Ability
文章作者:Jiale Zhang, Xue Liu, Qixuan Mu, Ruijun Li,* and Yibing Ji*
DOI:10.1002/chem.202303827
文章链接:https://chemistry-europe.onlinelibrary.wiley.com/doi/10.1002/chem.202303827
本文为科研用户原创分享上传用于学术宣传交流,具体内容请查阅上述论文,如有错误、侵权等请联系修改、删除。未经允许第三方不得复制转载。





