首页 >
行业动态 > 【COF光动力疗法】:卟啉共价有机骨架的同时质子化和金属化增强光动力疗法
【COF光动力疗法】:卟啉共价有机骨架的同时质子化和金属化增强光动力疗法
摘要:
芝加哥大学林文斌教授课题组报道的本篇文章(J. Am. Chem. Soc. 2024)中探讨了共价有机框架(COFs)在光动力疗法(PDT)中的应用,指出了COFs在PDT中存在的光激发态猝灭和活性氧(ROS)生成效率低的问题。作者提出了一种通过同时质子化和金属化策略,显著提高了二维亚胺连接卟啉COF的PDT效率。通过在有无氯化铁存在下,利用5,10,15,20-四(4-氨基苯基)卟啉和对苯二甲醛之间的亚胺缩合反应合成了中性未金属化的卟啉COF(Ptp)和质子化金属化卟啉COF(Ptp-Fe)。Ptp-Fe在光照下通过II型和I型PDT过程快速产生1O2和羟基自由基,还催化了在微酸性条件下的H2O2向羟基自由基的转化。Ptp-Fe介导的PDT在CT26和4T1癌细胞上表现出比Ptp更高的细胞毒性,并在小鼠结肠CT26癌症和4T1三阴性乳腺癌肿瘤中显示出强大的抗肿瘤效果。
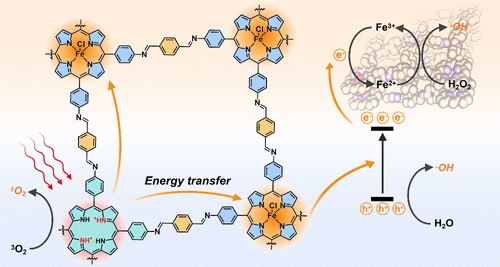
研究背景:
1. 传统的II型PDT使用光敏剂产生1O2,但存在光敏剂聚集引起的猝灭、肿瘤微环境中的低氧条件以及1O2氧化能力相对较低等问题。
2. 无机纳米材料如二氧化钛、氧化锌和氧化铈等已被证明可以在紫外光激发下通过电子转移过程产生超氧阴离子、过氧化氢和/或羟基自由基,但需要高能量的紫外光,组织穿透能力有限。
3. 作者提出了一种新的策略,通过同时质子化和金属化卟啉单元来增强COF的PDT效率,这种策略不仅提高了COFs在近红外区域的摩尔消光系数,还破坏了光敏单元间的共轭,从而减少了光激发态的猝灭。
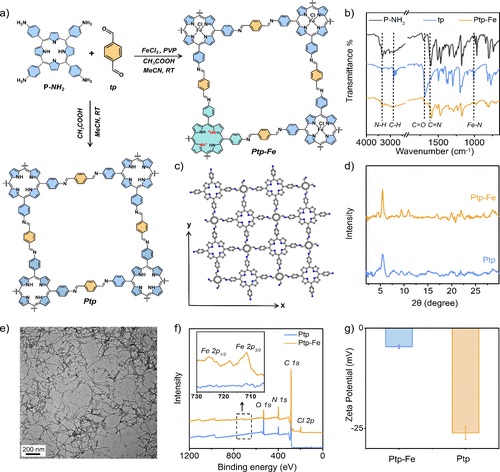
实验部分:
1. 合成实验:
- 作者通过亚胺缩合反应合成了中性未金属化的卟啉COF(Ptp)和质子化金属化卟啉COF(Ptp-Fe)。反应在存在或不存在氯化铁的情况下进行,以生成所需的COF结构。
2. 光物理性质测试:
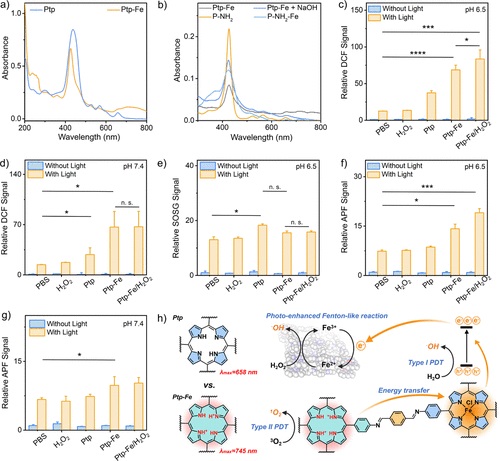
- 使用紫外-可见(UV-vis)光谱法测量了Ptp和Ptp-Fe的光学性质,包括Soret带和Q带的特征吸收。
3. ROS生成测试:
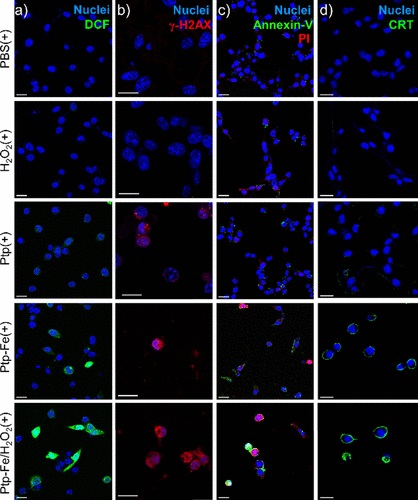
- 利用DCFH-DA试剂盒检测了Ptp和Ptp-Fe在不同pH条件下产生总ROS的能力,并通过1O2和·OH的特定检测方法评估了它们的PDT效果。
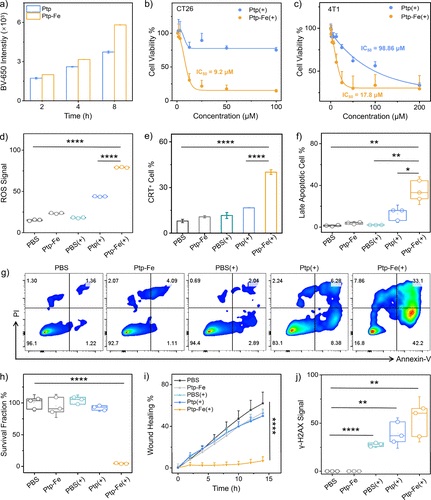
4. 细胞毒性和PDT效果测试:
- 在CT26和4T1细胞上评估了Ptp和Ptp-Fe的暗毒性和光毒性,通过MTS实验确定IC50值,并使用流式细胞仪和共聚焦激光扫描显微镜(CLSM)评估了Ptp-Fe诱导的免疫原性细胞死亡(ICD)和细胞凋亡。
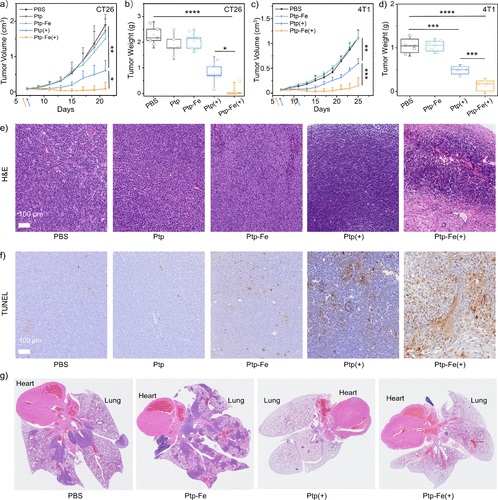
5. 体内抗肿瘤效果测试:
- 在小鼠CT26肿瘤模型中评估了Ptp-Fe的体内抗肿瘤效果,包括肿瘤体积和重量的测量,以及H&E和TUNEL染色评估肿瘤组织的形态和凋亡情况。
6. 突破性结果:
- Ptp-Fe在PDT中表现出比Ptp更高的细胞毒性和抗肿瘤效果,尤其在微酸性条件下,通过光增强的Fenton样反应进一步提高了ROS的生成。
分析测试:
1. FT-IR确认了Ptp-Fe中亚胺键的形成,观察到C=N伸缩振动的出现。PXRD显示Ptp和Ptp-Fe具有相同的2D结构和低结晶度。
2. 透射电子显微镜(TEM)观察到Ptp和Ptp-Fe分别呈现球形和纤维状形态。
3. 动态光散射(DLS):测量了Ptp和Ptp-Fe的粒径大小和分布, Ptp和Ptp-Fe粒径分布分别为63.4 ± 0.7 nm and 155.0 ± 0.6 nm for
4. 感应耦合等离子体质谱(ICP-MS):分析了Ptp-Fe中Fe3+离子的金属化程度。
5. X射线光电子能谱(XPS):确认了Ptp-Fe中C、N、Fe和Cl的存在,并确定了Fe 2p3/2峰的位置。
6. 紫外-可见吸收光谱:测量了Ptp和Ptp-Fe的光吸收特性,发现Ptp-Fe具有红移和增强的Q带吸收。
7. 流式细胞仪:用于评估Ptp和Ptp-Fe在CT26细胞中的摄取和PDT诱导的ICD。
8. 共聚焦激光扫描显微镜(CLSM):用于观察Ptp-Fe处理后CT26细胞的凋亡和细胞表面CRT的表达。
9. 细胞增殖实验(Clonogenic assay):评估了Ptp(+)和Ptp-Fe(+)对4T1细胞的抗增殖效果。
10. 细胞迁移实验(Scratch wound healing assay):评估了Ptp-Fe(+)对4T1细胞迁移的影响。
11. γ-H2AX表达分析:通过流式细胞术和CLSM成像显示Ptp-Fe(+)处理的CT26细胞中γ-H2AX的表达,指示DNA双链断裂的发生。
总结:
本文通过同时质子化和金属化策略,成功提高了卟啉COF的PDT效率。Ptp-Fe在光照下能够通过II型和I型PDT过程产生1O2和羟基自由基,并且在微酸性条件下催化H2O2转化为羟基自由基,显著提高了对CT26和4T1癌细胞的细胞毒性和体内抗肿瘤效果。
展望:
1. Ptp-Fe长期的生物相容性和潜在的毒副作用还需要进一步研究。
2. 建议作者探索Ptp-Fe在不同类型的肿瘤模型中的PDT效果,并研究其在临床应用中的潜力。
3. 建议与临床医学家合作,将Ptp-Fe集成到临床试验中,评估其作为新型光敏剂在癌症治疗中的有效性和安全性。
Simultaneous Protonation and Metalation of a Porphyrin Covalent Organic Framework Enhance Photodynamic Therapy
文章作者: Wenyao Zhen, Dong Won Kang, Yingjie Fan, Zitong Wang, Tomas Germanas, Geoffrey T. Nash, Qijie Shen, Rachel Leech, Jinhong Li, Gregory S. Engel, Ralph R. Weichselbaum, and Wenbin Lin*
DOI:10.1021/jacs.4c03519
文章链接:https://pubs.acs.org/doi/10.1021/jacs.4c03519
本文为科研用户原创分享上传用于学术宣传交流,具体内容请查阅上述论文,如有错误、侵权等请联系修改、删除。未经允许第三方不得复制转载。





