首页 >
行业动态 > 【MOF载药】:多孔框架材料在生物成像和癌症治疗中的应用
【MOF载药】:多孔框架材料在生物成像和癌症治疗中的应用
摘要:
本文(Molecules 2023, 28, 1360)综述了多孔框架材料,包括金属有机框架(MOFs)、共价有机框架(COFs)和多孔配位笼(porous coordination cages-PCCs)在生物成像和癌症治疗方面的最新进展。这些新方法在减少副作用和协同增强抗癌功效方面显示出显著优势。除了上述治疗方法外,病灶区域的早期诊断和原位监测对于减少副作用和提高癌症治疗成功率也很重要,这依赖于生物成像技术的良好应用。本文还提出了基于多孔框架材料的生物成像和癌症治疗面临的未来挑战。
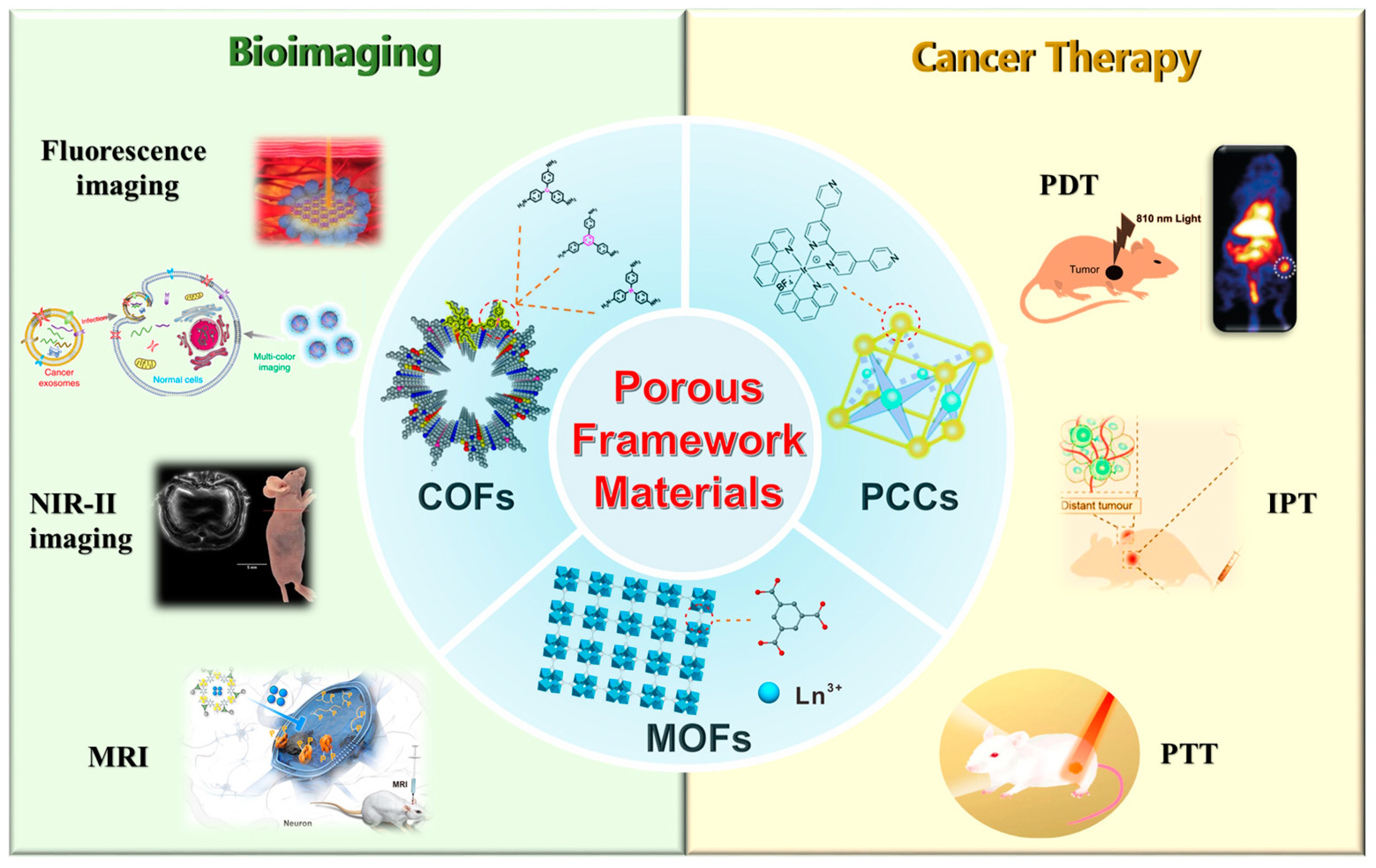
背景介绍:
癌症仍然是世界上最紧迫的疾病之一。传统的治疗方法,包括手术、化疗和放疗,仍然存在一定的局限性。研究者们提出了许多新的癌症治疗方法,包括:
(1)光热治疗:利用特殊纳米材料在近红外光照射下产生热量,选择性杀死癌细胞。
(2)化学动力治疗:利用过渡金属离子催化过氧化氢产生羟基自由基,诱导肿瘤细胞凋亡。
(3)免疫治疗:通过调节机体免疫系统,增强机体抗肿瘤免疫应答。
(4)联合治疗:将上述两种或多种治疗方法相结合,协同抗癌。
综述总结:
多孔框架材料在生物成像中的应用
1.1 MOF在生物成像中的应用
(1)Liang等通过掺杂近红外花菁染料(IR-3C)到Ln基MOF中,增强了MOF对激发光子的吸收,实现了近红外二区(NIR-II)发射和高发光效率,可用于生物成像。
(2)Qiao等成功开发了一种新型靶向给药载体MILB@LR用于胶质母细胞瘤的有效治疗。利用MOF作为造影剂,修饰后的MILB@LR可以通过血脑屏障到达脑肿瘤细胞,实现靶向脑肿瘤细胞成像的效果。
(3)Li课题组制备了一种基于Zr的MOF(ZrTc),利用4,4’-(噻唑[5,4-d]噻唑-2,5-二基)二苯甲酸(Tc)作为多光子活性单元。ZrTc表面经配体相互作用进行功能化修饰,获得具有良好稳定性和肿瘤细胞特异性靶向能力的ZTIG。在近红外二区光激发下,其荧光成像具有高空间分辨率和深组织穿透性,使其成为癌症诊断的潜在材料。
1.2 COF在生物成像中的应用
(1)Zeng等制备了一种苯并噻二唑基共价有机框架TPI-COF,可以促进双光子诱导(TPI),表现出高效的TPI荧光发射。进一步建立Balb/c小鼠4T1肿瘤异种移植模型,验证了TPI-COF在体内的可行性。
(2)Zhang等选择4-氨基-1,8-萘酰亚胺衍生物(NPHS)作为双光子荧光探针,通过对甲苯磺酸介导的溶剂热法制备了具有双光子荧光的COF纳米探针TpASH-NPHS,用于靶向硫化氢作为模型分析物。与小分子探针相比,TpASH-NPHS COF表现出高H2S选择性和低细胞毒性,可用于深层肿瘤组织的荧光成像。
(3)Tang课题组通过冷冻法制备了一种基于COF的三色荧光纳米探针(COF@survivin/MUC1),并将其应用于活细胞中不同分布生物标志物的同时成像。COF@survivin/MUC1由吸附Cy5标记的适配体MUC1和TAMRA标记的survivin mRNA反义寡核苷酸的COF纳米颗粒组成。与现有纳米探针相比,该材料的内在荧光可以监测纳米探针在细胞内外的分布。
1.3 PCC在生物成像中的应用
(1)Zhao课题组报道了一种由结构稳定的锆(IV)配位笼和聚集诱导发射(AIE)分子转子组装而成的组装体,并将其应用于体外生物成像。结果表明,通过限制AIE分子转子的动力学行为,可以有效控制笼的荧光发射强度。由于配位笼在水溶液中具有优异的化学稳定性,分子转子具有良好的AIE性质,因此可以作为新型荧光探针用于活细胞体外成像。
(2)Zhao等利用具有AIE活性和刺激响应能力的POC实现生物成像。值得注意的是,在温和条件下,配位单元中的亚胺键完全转化为胺键,大大提高了其亲水性和活细胞成像效率。
(3)Dana Al Kelabi等报道了一种具有生物活性和线粒体靶向性的互惠异三聚有机笼。他们证明了一种具有高细胞通透性和令人印象深刻的光稳定性的生物相容性有机笼(OC1)可以用作线粒体靶向荧光探针。值得注意的是,其稳定性和荧光性能优于一些商业材料。
多孔框架材料在癌症治疗中的应用
2.1 MOF在癌症治疗中的应用
(1)Li课题组通过点击反应合成了一种双光子活性金属有机框架PCN-58-Ps。然后通过透明质酸(HA)通过配位效应封装PCN-58-Ps,获得功能化的PCN-58-Ps-HA,其孔道有效防止了Ps聚集。他们发现PCN-58-Ps的ROS生成与Ps的系统间交叉(ISC)和PCN-58的配体-团簇电荷转移(LCCT)有关。在910 nm的近红外激光照射下,具有双光子活性的PCN-58-Ps-HA可以产生大量ROS(1O2和O2•-),这是细胞凋亡的关键因素。
(2)Lin等构建了一种基于Hf12和2",3’-二硝基-[1,1’:4’,1";4",1"‘-四苯基]-4,4"’-二羧酸(QC)的纳米级金属有机框架(nMOF) Hf-QC,然后将锌酞菁(ZnP)封装到刚性Hf-QC骨架的孔中制备ZnP@Hf-QC。这种复合材料避免了ZnP聚集诱导的激发态爆发,在光照下显著增强ROS的产生。重要的是,其介导的PDT具有更好的生物相容性。实验结果证明,在小鼠结肠癌模型中可以实现超高的肿瘤生长抑制率和治愈率,具有优异的抗肿瘤效果。
(3)Shen等报道了一种含有胡椒酰胺(PL)、聚多巴胺(PDA)和新型吲哚菁绿(IR820)修饰的纳米级MOF,即MP@PI。他们发现MOF和PL分别被用作CDT的铁源和H2O2源。此外,MOF和PL可以促进肿瘤细胞中的铁死亡,进一步导致ROS产生、脂质过氧化物(LPO)积累和谷胱甘肽过氧化物酶4(GPX4)下调。在PTT的辅助下,该纳米平台被用于诱导体内免疫应答,实现体外和体内的协同抗肿瘤效果。
2.2 COF在癌症治疗中的应用
(1)Xie课题组通过室温下丙酮中的席夫碱反应合成了一种具有可调尺寸和强胶体稳定性的新型COF,该COF由电子缺陷噻吩异吲哚和电子富集三苯胺(TPAT COF)构建。由于COF π-π共轭骨架的分子内电荷转移效应和延伸,TPAT COF即使在NIR-II也表现出宽的吸收。此外,该COF在808 nm激光照射下具有较高的光热转换效率(PCE),使其表现出显著的癌细胞杀伤效果。
(2)Jing课题组也通过温和条件下的席夫碱反应获得了一系列尺寸可控的COF。有趣的是,经1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-N-[甲氧基(聚乙二醇)](MPEG 2000-DSPE)修饰的COF在水中表现出优异的胶体稳定性和生物相容性。此外,这些COF表现出宽的吸收光谱,其最大吸收波长可以通过优化给体结构进行调节,甚至可以覆盖NIR-II生物窗口,在激光照射下有效抑制肿瘤生长。
(3)Tang等使用电子富集的4,4’,4",4"‘-[卟啉-5,10,15,20-四基]四苯胺(TAPP)和电子缺陷的4,4’-[苯并噻二唑-4,7-二基]-二苯甲醛(BDA)构建TB-COF。在激光照射下,TB-COF中给体和受体之间发生显著的光诱导电子转移(PET),将吸收的光能转化为热能,导致肿瘤消融。其光热转换效率与常用的PTT材料相当。此外,在TB-COF表面包裹一层HA(TPA-COF-HA)大大提高了其生物相容性,实现了肿瘤靶向,从而提高了治疗效果和药物安全性。
2.3 PCC在癌症治疗中的应用
(1)Chen课题组利用模板导向策略合成了一种卟啉纳米笼,通过聚乙二醇链的后修饰进一步构建成porSMNPs。这种功能化的porSMNPs可以作为治疗诊断平台,利用放射性64Cu标记成像监测药物代谢的整个过程。此外,笼状结构通过抑制Ps的π-π堆积相互作用显著提高了porSMNPs的光敏性能,从而增强了PDT中的抗肿瘤性能。
(2)Su等制备了一种由八个Ir(III)基Ps和四个Pd基受体组成的光活性高度有序立方体[Pd4Ir8]16+笼(MOC-53)。这种笼材料被用作高效的线粒体靶向单光子和双光子PDT试剂。MOC-53具有优异的1O2产生效率、细胞摄取能力和特异性线粒体靶向能力,可有效导致癌细胞死亡。
总结与展望:
1. 多孔框架材料在生物成像和癌症治疗方面取得了巨大进展,包括:
(1)通过调控组分和结构,可以轻松调节多孔框架材料的光学性质,在生物成像方面实现出色性能。
(2)多孔性是提高载药能力的独特优势,在癌症治疗方面显示出前景。
(3)精确的结构有利于研究"结构-性能关系"。
2. 但在癌症治疗的应用方面仍处于早期阶段,未来需要解决的问题包括:
(1)阐明多孔框架材料的体外和体内代谢途径,需要材料具有快速降解和体内清除能力。
(2)长期、更深入地评估纳米材料的生物毒性,材料稳定性越高,降解可能越困难,这对其高生物安全性有影响。
(3)通过多孔框架材料激活免疫应答在癌症治疗中仍未取得满意结果。
3. 未来需要进一步研发的工作包括:
(1)在多孔框架材料的合理结构设计,包括选择低毒性的金属离子和配体,以及在生物环境中的稳定性。
(2)由于大多数材料的荧光性质在生物环境中容易受到影响,有必要设计开发适用于体内成像的优异荧光材料作为探针。
Porous Framework Materials for Bioimaging and Cancer Therapy
文章作者:Meng Jin , Yingying Zhao , Zong-Jie Guan and Yu Fang *
DOI:10.3390/molecules28031360
