首页 >
行业动态 > 【纳米PCN-222】微环境调控打破纳米酶固有pH限制以增强其活性
【纳米PCN-222】微环境调控打破纳米酶固有pH限制以增强其活性
摘要:
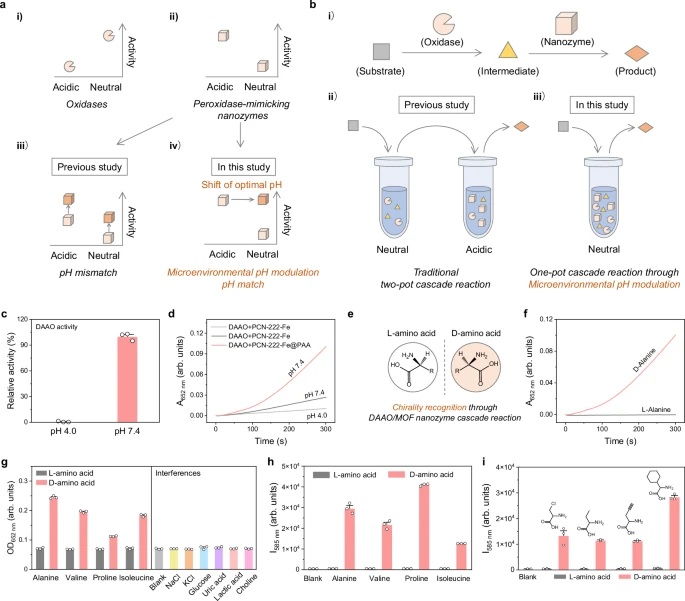
天津大学武江洁星和南京大学董昊、魏辉老师等报道的本篇文章(Nat Commun 15, 10861 2024)中提出了一种通过调控金属-有机框架(MOF)纳米酶的微环境pH值来克服其固有pH限制的策略。研究者们将聚酸或聚碱(作为Brønsted酸或碱)限制在MOF纳米酶的通道中,以改变其微环境pH值。实验和分子动力学模拟表明,聚丙烯酸(PAA)的限制不仅通过捐赠质子,还通过在中性pH条件下,聚丙烯酸的去质子化羧基与水合氢离子之间形成的盐桥来保持质子,从而降低了MOF纳米酶的微环境pH值,使其在pH 7.4时表现出最佳活性,解决了与酸变性的氧化酶耦合的级联系统中的pH不匹配问题。相反,聚乙烯亚胺(PEI)的限制增加了微环境pH值,增强了MOF纳米酶的水解酶样活性。这一策略为设计高性能纳米酶和纳米催化剂提供了新的途径。
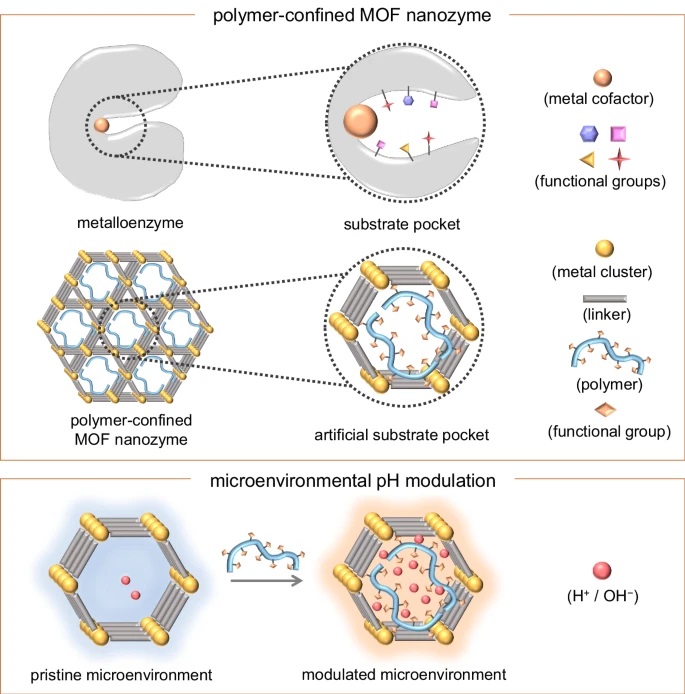
研究背景:
1. 纳米酶作为一种具有酶模拟活性的功能性纳米材料,在生物分析、治疗、环境保护等领域有着广泛的应用前景。然而,纳米酶的催化活性强烈依赖于pH值,其最优pH值通常与实际应用中的工作pH值存在偏差,这限制了纳米酶的实际应用。例如,过氧化物酶样纳米酶在酸性pH下具有最佳活性,但在生理条件下(通常是中性pH)应用时,活性显著降低。
2. 尽管已有研究致力于设计高活性纳米酶,但目前仍缺乏一种普遍有效的策略来解决纳米酶的pH限制问题。
3. 受天然酶的启发,作者提出了一种微环境调控策略,通过引入羧基(Brønsted酸)捐赠质子和氨基(Brønsted碱)接受质子,分别降低和提高催化活性位点附近的微环境pH值,而不改变溶液的总体pH值。作者选择了金属-有机框架(MOFs)作为研究对象,因为MOFs具有与金属酶类似的特性,其金属节点和连接体可以作为催化活性位点,且其孔隙和通道易于修饰,为微环境pH值的精细调控提供了可能。
实验部分:
1.PCN-222-Fe NPs的制备:
1) 将100 mg Fe-TCPP、300 mg ZrOCl2•8H2O和3.3 g BA溶解在100 mL DMF中,使用250-mL烧瓶。
2) 将溶液转移到油浴中,在90 °C下加热5小时,轻轻搅拌。
3) 冷却至室温后,通过离心(14,800 × g,20分钟)收集PCN-222-Fe NPs,并用DMF洗涤三次。
4) 将得到的PCN-222-Fe NPs储存在4 °C下以供进一步使用。
2.PCN-222-Fe@PAA NPs的制备:
1) 将等体积的0.5 mg/mL PCN-222-Fe NPs和1 mg/mL PAA混合,在室温下孵育30分钟。
2) 最终浓度分别为0.25 mg/mL的PCN-222-Fe NPs和0.5 mg/mL的PAA。
3) 对于活性测量,孵育后直接使用混合物。对于表征(如SEM、TEM、DLS、zeta电位和XPS光谱),PCN-222-Fe@PAA NPs用蒸馏水洗涤三次。
3.过氧化物酶样活性测量:
1) 在典型程序中,将等体积的0.5 mg/mL PCN-222-Fe NPs和1 mg/mL聚合物(PAA、PSS和PAH)混合,在室温下孵育30分钟。
2) 向上述溶液中加入40 µL的10 mM TMB,然后加入1.88 mL的0.2 M Tris缓冲液(pH = 7.4),最后加入40 µL的10 mM H2O2。
3) 使用分光光度计监测反应溶液在652 nm处的吸光度变化。对于荧光底物Amplex Red,向1.95 mL的0.2 M Tris缓冲液(pH = 7.4)中加入10 µL的20 mM Amplex Red(在DMSO中)和20 µL的0.5 mg/mL PCN-222-Fe@PAA NPs,然后加入20 µL的10 mM H2O2。
4) 通过在585 nm处的荧光强度变化监测Amplex Red的过氧化物酶反应,激发波长为560 nm,使用微孔板读数器。根据比尔-朗伯定律计算初始速率。
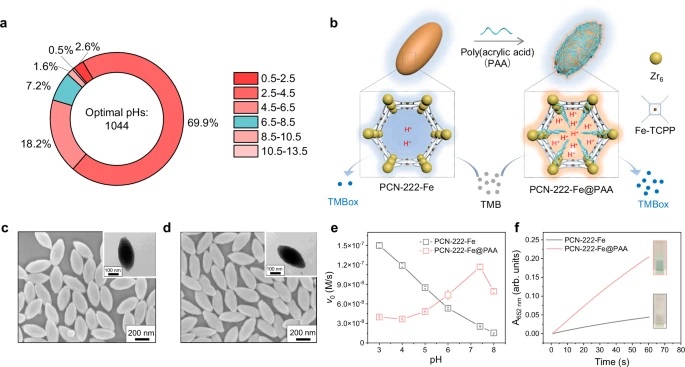
4.pH依赖性过氧化物酶样活性测量:
1) 向1.88 mL不同pH值(3‒6为醋酸盐缓冲液,7‒8为Tris缓冲液)的0.2 M缓冲液中依次加入40 µL的0.25 mg/mL PCN-222-Fe NPs(或PCN-222-Fe@PAA NPs)、40 µL的10 mM TMB和40 µL的10 mM H2O2。
2) 监测652 nm处的吸光度变化并计算初始速率。
分析测试:
1.样品形态学表征:
- 使用Zeiss场发射扫描电子显微镜(SEM)检查PCN-222-Fe NPs和PCN-222-Fe@PAA NPs的形态。PCN-222-Fe NPs呈纺锤形,长度和宽度分别为360 ± 35 nm和171 ± 16 nm;PCN-222-Fe@PAA NPs的长度和宽度分别为368 ± 30 nm和166 ± 16 nm。
2.N2吸附-脱附等温线:
- 在Quantachrome Autosorb-iQ2-MP体积气体吸附分析仪上获得PCN-222-Fe NPs和PCN-222-Fe@PAA NPs的77 K N2吸附-脱附等温线,之前在150 °C下真空脱气过夜。结果显示PCN-222-Fe@PAA NPs相比PCN-222 NPs氮气吸附量和孔容减小,证实PAA能够被限制在MOF通道内。
3.表面物种分析:
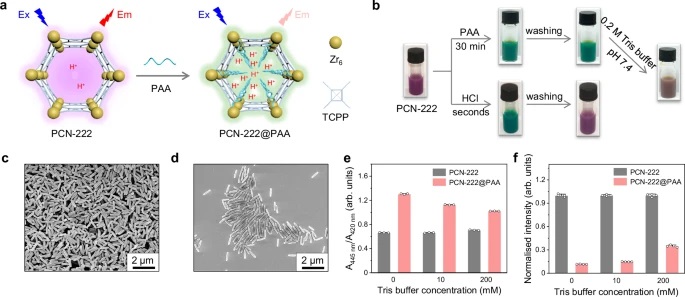
- 使用X射线光电子能谱(XPS)系统(Axis Supra, Kratos Analytical Ltd., UK)进行,使用Al Kα X射线源(1486.6 eV)在200 W下进行概览扫描,在300 W下进行核心级光谱分析。Zr 3d5/2的结合能从182.4 eV增加到182.6 eV,证明了PAA通过PCN-222-Fe NPs的Zr6簇与PAA的羧基之间的配位进行修饰。
4.粉末X射线衍射(PXRD)结果:
- 使用Rigaku MiniFlex X射线衍射仪和Cu Kα辐射,扫描速度为10°/min获得PCN-222-Fe NPs和PCN-222-Fe@PAA NPs的PXRD图谱。PCN-222 NPs的XRD图谱与模拟的PCN-222相匹配,PAA修饰后XRD图谱保持不变,表明PAA成功修饰且未改变晶体结构。
5.衰减全反射傅里叶变换红外光谱(ATR-FTIR):
- 在Bruker V70仪器上进行ATR-FTIR分析,以确认PAA的成功修饰。
6.静态水接触角(WCAs)测定:
- 使用OCAH200接触角测量仪(DataPhysics, Germany)记录PCN-222-Fe NPs和PCN-222-Fe@PAA NPs的水接触角,以评估其亲水性/疏水性。
7.紫外-可见(UV-vis)光谱记录:
- 在Shimadzu UV-2501 PC分光光度计上以吸光度模式记录PCN-222 NPs和PCN-222@PAA NPs在不同pH值下的UV-vis光谱,以监测吸收峰的变化,从而推断局部pH的变化。
8.比表面积和孔隙结构分析:
- PCN-222-Fe NPs和PCN-222-Fe@PAA NPs的比表面积分别为191.4 m²/g和189.2 m²/g,孔径分布中心在~2 nm。
9.XPS分析:
- PCN-222-Fe@PAA NPs的XPS谱图显示了N 1s的强烈峰,Zr 3d5/2的结合能从182.4 eV增加到182.6 eV,表明PAA成功修饰。
10.FTIR分析:
- PCN-222-Fe@PAA NPs的FTIR谱图在1000到1100 cm⁻¹处的吸收增加,归因于PAA的羧基和PCN-222-Fe NPs的Zr-O键的伸缩振动。
11.WCA测定:
- PCN-222-Fe@PAA NPs相比PCN-222-Fe NPs显示出更高的疏水性,水接触角显著增大。
12.UV-vis光谱分析:
- PCN-222@PAA NPs在中性pH下显示出比PCN-222 NPs更低的荧光强度,表明PAA修饰降低了微环境pH值。
13.水稳定性测试:
- PCN-222-Fe@PAA NPs在333 K下浸水4小时后,晶体结构保持良好,显示出优异的水稳定性。
14.固定化脂肪酶性能评估:
- PCN-222-Fe@PAA NPs展示出最高的特异性活性和活性恢复率,在酸解反应中表现出更高的反应速率和转化率。
15.脂肪酶重复使用性评估:
- PCN-222-Fe@PAA NPs在五个酸解批次后保持了90.09%的活性,显示出优异的重复使用性。
总结:
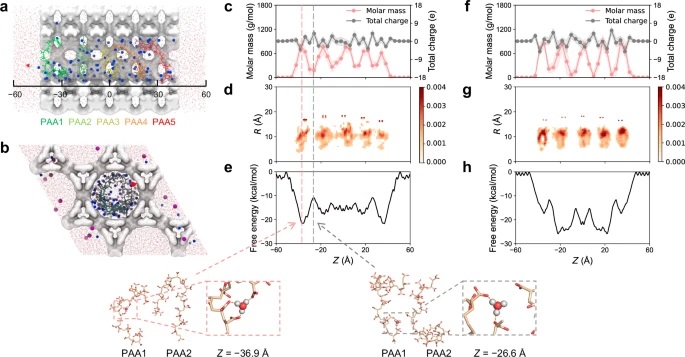
文章通过实验和分子动力学模拟,成功地展示了通过限制聚酸或聚碱来调控MOF纳米酶的微环境pH值,从而打破了纳米酶的固有pH限制,增强了其在生理pH下的活性。这一策略不仅解决了纳米酶在实际应用中的pH不匹配问题,还为设计高性能纳米酶和纳米催化剂提供了新的思路。
展望:
这篇文章的积极影响在于为纳米酶的应用提供了更广泛的pH适应性,有望在生物医学、环境监测等领域得到更广泛的应用。未来的研究可以进一步探索其他类型的聚酸或聚碱对不同MOF纳米酶的影响,以及这种微环境调控策略在其他类型的纳米催化剂中的普适性。此外,研究者还可以探索这种策略在体内环境中的稳定性和生物相容性,为纳米酶的临床应用奠定基础。
Microenvironmental modulation breaks intrinsic pH limitations of nanozymes to boost their activities
文章作者:Tong Li, Xiaoyu Wang, Yuting Wang, Yihong Zhang, Sirong Li, Wanling Liu, Shujie Liu, Yufeng Liu, Hang Xing, Ken-ichi Otake, Susumu Kitagawa, Jiangjiexing Wu, Hao Dong & Hui Wei
DOI:10.1038/s41467-024-55163-4
文章链接:https://www.nature.com/articles/s41467-024-55163-4




